Bundesrepublik Deutschland
Patentenschrift DE 195 22 226 C2
Int. Cl.6: H 01 M6/32
Anmeldetag: 20.6.95
Offenlegungstag: 2.1.97
Veröffentlichungstag der Patenteerteilung 25.3.99
Patenteninhaber: Kipnis, Alexander, 68259 Mannheim, DE
Mikhailova Nina, 68259 Mannheim, DE
Wasseraktivierte Primärzellen und deren Verwendung in einer wasseraktivierten Batterie
Beschreibung
Die vorliegende Erfindung bezieht sich auf Reserve-, oder aktivierbare Primärzellen und -batterien, insbesondere auf durch Wasser aktivierte Zellen und Batterien.
Verschiedene Primärzellen für aktivierbare Batteriesysteme sind bekannt. Einige sind für diejenigen Systeme bestimmt, in denen sowohl der Elektroden- oder Zellensatz als auch der Elektrolyt sich voneinander getrennt befinden bis zum Moment der Aktivierung.
(Siehe z.B.: US 3,653,972 und H.-D. Jaksch. Batterie- Lexikon, Pflaum Verlag, München, 1993, S. 9ff., 470 ff.). Andere sind für die Systeme bestimmt, in denen der Elektrolyt, in der Regel Seewasser, sich außerhalb des Systems befindet und für die Aktivierung von außen an die Elektroden zugeführt wird. (Siehe z. B. Ullmanns Encyclopedia of Industrial Chemistry, 5th ed., 1985, vol. A3, p. 395).
Die erfindungsgemäßen Primärzellen und -batterien sind in beiden genannten Varianten realisierbar. Ihre Vorteile treten jedoch vor allem bei der Aktivierung von außen hervor.
Es wurde eine Reihe von wasseraktivierten Zellen und Batterien vorgeschlagen, insbesondere solche mit Magnesiumanoden und mit Kathoden, die in sich Silberchlorid, Kupferchlorid oder Bleichlorid enthalten. Üblicherweise ist ein depolarisierendes Material der Kathode mit einem leitenden Metallgitter oder einem Metallnetz verbunden. Als andere Depolarisatoren beschreibt DE-OS 15 96 187 Kalium-, Ammonium- und Natrium-Persulfate und deren Gemische, wobei man ein Gemisch eines feinverteilten Persulfats und feinverteilter Kohle benutzt. Als andere Depolarisatoren beinhalten DE 25 00 675 A1 und DE 28 07 852 Al organische Chlor- oder Bromverbindungen.
Die DE 29 47 236 Al erhebt den Anspruch auf eine durch Meerwasser aktivierte Reservebatterie, die eine Anode aus Magnesium, Aluminium, Zink- oder Legierungen daraus und eine depolarisierende Kathode enthält, die aus einem leitenden Metallgitter besteht, das mit einem depolarisierenden Material überzogen ist, dadurch gekennzeichnet, daß das Kathodendepolarisatormaterial Cupro- thiocyanat, Schwefel und Kohlenstoff enthält.
Alle diese Primärzellen haben folgende Nachteile:
Meerwasser ist für die Aktivierung notwendig.
Die Wirkung ist instabil in dem Sinne, daß der Strom und Klemmenspannung laufend bei Entladung abnehmen.
Die erreichbaren Stromdichten sind ziemlich niedrig und 45 liegen zwischen 1 und 10 mA/cm2.
Der Ausnutzungsgrad des depolarisierenden Materials (des Oxidationsmittels) erreicht sogar in günstigsten Fällen nicht mehr als 80-90%.
Bei Batterien aus diesen Zellen ist die Umpolung möglich, was ihre Zuverlässigkeit vermindert; um die Umpolung zu vermeiden, fügt man besondere elektronische Systeme ein, die das versagende Element abschalten.
Endlich sind diese Elemente für die Umwelt ungünstig, weil sie gefährliche Komponenten, wie Schwermetalle, enthalten.
Es ist eine Aufgabe der Erfindung, eine im wesentlichen von den genannten Nachteilen freie aktivierte Primärzelle von hohem Reaktantenausnützungsgrad - und folglich leicht vorwählbarer Entladungskapazität, stabilen Entladungsstrom- und Spannungswerten, Einfachheit und Sicherheit beim Betrieb, hohe Umweltverträglichkeit, sowie eine Batterie, in der diese Zelle verwendet werden kann, bereitzustellen.
Erfindungsgemäß wird diese Aufgabe dadurch gelöst, daß in der Zelle mit einer Anode aus Lithium, Magnesium oder einer Magnesiumlegierung die Kathode aus zwei mit einem leitenden Metallgitter verbundenen Schichten besteht, wobei die der Anode zugewandte Schicht aus einem leitenden porösen hydrophoben Material zusammengesetzt und mit dem Metallnetz direkt verbunden ist, und die andere Schicht enthält mindestens eine aktive Substanz, die als Verbindungen oder im Gemische mit einem Füllstoff vorliegt und die eine depolarisiende, d. h. mindestens ein Oxidationsmittel enthaltende leitende Lösung bei Wechselwirkung mit dem Wasser bilden.
Im folgenden werden, der Knappheit wegen, die leitende poröse hydrophobe Schicht ”die poröse Schicht" und die aktive Stoffe enthaltende Schicht "die aktive Schicht" genannt.
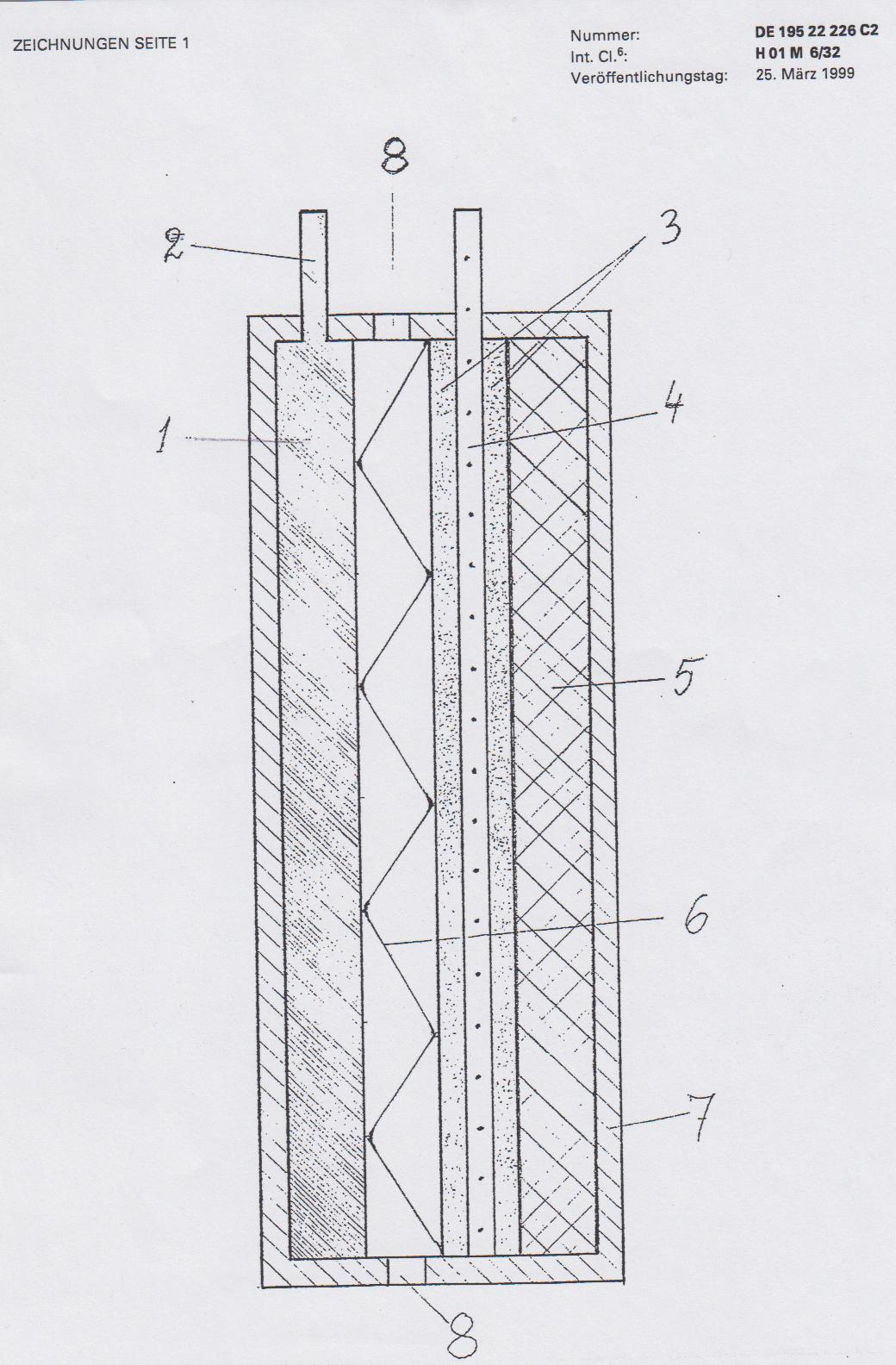
Die Fig. 1 veranschaulicht schematisch eine erfindungsgemäße Zelle, ohne Einzelheiten der Konstruktionsausgestaltung, die sehr unterschiedlich sein kann, zu zeigen. Die Zelle enthält die Anode (1) aus einem leichten, gegenüber Wasser hochreaktionsfähigen Metall oder einer Legierung; die Anode hat den entsprechenden Stromabnehmer (2). Die Kathode besteht aus einer porösen Schicht (3), einem stromableitenden Metallnetz (4) und aus einer aktiven Schicht (5); die beiden Schichten sind untereinander und mit dem Metallnetz (4) verbunden, die erste direkt und die zweite indirekt. Die Kathode ist von der Anode durch eine Zwischenlage (6) getrennt, die eine Berührung der Elektroden ausschließt. Das Zellengehäuse (7) hat Einfüllöffnungen (8), um zur Aktivierung Wasser an die Elektroden zu führen.
Bei der vorliegenden Erfindung kann als Anodenmaterial Lithium, Magnesium oder eine Magnesiumlegierung verwendet werden; es gibt aber Preferenzen, die später erklärt werden.
Es ist auch wichtig anzumerken, daß unter verschiedenen Materialien, die für das ableitende Metallnetz getestet wurden (wie Kupfer, Monelmetall, nichtrostende Stähle), Nickel die besten Ergebnisse zeigte. Das ist bedingt nicht nur durch die Beständigkeit des Nickels gegen Oxidation, sondern durch seine katalytischen Eigenschaften.
Eine der wichtigen Besonderheiten der erfindungsgemäßen Zelle ist wie folgt: Dank dem Vorhandensein der porösen leitenden Schicht, die die aktive Schicht der Kathode vom Elektrolyt trennt, wird das Oxidationsmittel vollständig und ausschließlich für die elektrochemische Reaktion verbraucht. Der Ausnutzungsgrad des Oxidationsmittels kommt also an 100% heran. Das Oxidationsmittel erreicht den Zwischenelektrodenraum nicht; so ist irgendeine Passivierung des Anodenoberfläches wegen der Wechselwirkung mit dem Oxidationsmittel ausgeschlossen. Das bedeutet seinerseits sowohl die Verhinderung der Anodenpolarisation als auch eine Erhöhung des Anodenmaterialsausnutzungsgrads.
Die nächste Besonderheit der Zellenfunktion ist dadurch bestimmt, daß sich das Oxidationsmittel (Depolarisator) mittels der Wirkung des Wassers auf die aktive Schicht der Kathode bildet und in Lösung übergeht, wobei die Diffusionskinetik dieser Vorgänge einen stabilen Stationärzustand des Ausgleichs zwischen Stromdichte und Bildungsgeschwindigkeit des Oxidationsmitttels bedingt.
Selbstverständlich ist die letztere abhängig von der Natur der Substanzen, die die aktive Schicht der Kathode bilden. Bei gleichen übrigen Bedingungen ist aber die Stromdichte durch den Porengrößenaufbau und die Stärke der porösen Schicht der Kathode bestimmt.
Um die obengenannte Effekte zu erreichen, muß man also die Stärke der porösen Schicht entsprechend der benötigten Stromdichte bestimmen; diese Stärke kann z. B. von 0,2 bis 1 mm sein. Es wurde festgestellt, daß das optimale Material für die poröse Schicht der Kathode Aktivkohle ist, in Korngrößen von 0,1 bis 0,5 mm, die durch 1-15%, am besten 2-10% Polytetrafluorethylen hydrophobisiert und verbunden ist. Die aktive Schicht kann von verschiedener Stärke sein, je nach erwünschter Kapazität der Zelle: Die Schicht muß jedenfalls die notwendige Menge an gebundenem Oxidationsmittel enthalten.
Einige konkrete Varianten der erfindungsgemäßen Zelle sind möglich.
Wenn eine kurze, aber stromintensive Leistung nötig ist, muß die aktive Schicht der Kathode aus einer durch ein Bindemittel verbundenen leicht löslichen und sehr reaktionsfähigen anorganischen Peroxidverbindung, wie Natriumpercarbonat, vgl. Römpp Chemie Lexikon, 9. Auflage, Bd. 4, 1991, S. 2933 (Bezeichnung für Natriumcarbonat-Peroxohydrat), zusammengesetzt sein; ein Gemisch aus Natriumperoxid und einem Alkalisalz, wie Kaliumcarbonat, ist auch verwendbar, wobei die optimalen Molarverhältnisse des Natriumperoxids und des Alkalisalzes bei 1:1, jedenfalls zwischen 1,5 : 1 und 1: 1,5 liegen. Die poröse Schicht besteht dabei aus Aktivkohle, bevorzugt von Korngröße 0,3-0,5 mm. Als Anodenmaterial kann Lithium benutzt werden.
Wird eine langanhaltende, stabile Leistung benötigt, muß eine Magnesiumanode und eine Kathode mit poröser Schicht von mittlerer Porosität und mit aktiver Schicht aus durch ein Bindemittel verbunden Carbamidperoxid (Harnstoff-Wasserstoffperoxid) benutzt werden:
Es wurde festgestellt, daß eine Legierung von Magnesium mit 2% von Aluminium das beste Anodenmaterial für solche Fälle ist. Durch Anwendung dieser Legierung vermeidet man die durch Magnesiumhydroxidsanlagerung bedingte Anodenpolarisation; gleichzeitig ist die Wasserstoffentwicklung viel niedriger als bei reinem Magnesium, wobei Stromdichte und Klemmenspannung ebenso hoch sind, wie sie bei reinem Magnesium ohne Polarisation wären.
Von der anderen Seite ist die konventionelle Magnesiumlegierung für Korrosionsschutz (Magnesium mit 6% Aluminium und 3% Zink) nur für geringe Stromdichten anwendbar. Z. B., unter denselben übrigen Bedingungen, und zwar bei Kathoden mit aktiver Schicht aus Carbamidperoxid und bei Klemmenspannung von 1,0 V, zeigten Anoden aus reinem Magnesium die Stromdichte von 15-16 mA/cm2, Anoden aus Magnesiumlegierung mit 6% Al und 3% Zn - 3-5 mA/cm2 und Anoden aus Magnesiumlegierung mit 2% Al -20-22 mA/cm2.
Im folgenden wird die Erfindung durch Beispiele näher erläutert, auf die sie sich jedoch nicht beschränkt.
Bei sämtlichen Beispiele wurden als leitende Metallgitter ein Nickeldrahtnetz von Maschenweite 0,5-1,0 mm und als Bindemittel Polytetrafluorethylensemulsion bzw. Polyethylenpulver verwendet; die Elektroden haben die Ausmaße von 20 x 20 cm.
Beispiel 1
Die Anode wurde aus metallischem Magnesium hergestellt, die Kathode durch Aufpressen auf das Nickelnetz zuerst einer Mischung von Aktivkohle der Korngröße 0,3-0,4 mm mit 5% Polytetrafluorethylen und danach eines Gemisches aus Natriumpercarbonat mit 15% Polyethylen. Nach Einfüllen von Meerwasser wurde während weniger als 1 sec die Stromdichte von 30 mA/cm2 bei einer Spannung von 1,0 V entwickelt. Sie blieben über 12 min stabil. Ausnutzungsgrad des Oxidationsmittels war in diesem Fall 69%.
Beispiel 2
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit einer Anode aus der Legierung von Magnesium mit 2% Aluminium. Bei derselben Klemmenspannung von 1,0 V wurde die Stromdichte von 32 mA/cm2 entwickelt, die während 15 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war 93%.
Beispiel 3
Die Anode wurde aus einer Legierung von Magnesium mit 2% Aluminium hergestellt, die Kathode durch Aufpressen auf das Nickelnetz zuerst einer Mischung von Aktivkohle der Korngröße 0,3-0,4 mm mit 7% Polytetrafluorethylen und danach eines Gemisches aus Natriumperoxid und Kaliumcarbonat im Molarverhältnis 1: 1 mit 12% Polyethylen. Bei Klemmenspannung von 1,0 V wurde die Stromdichte von 31 mA/cm2 entwickelt, die während 15 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war 91%.
Beispiel 4
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit dem Molarverhältnis Natriumperoxid. Kaliumcarbonat wie 1,5: 1. Bei gleicher Klemmenspannung und Stromdichte war die Stabilbetriebszeit 10 min. Der Ausnutzungsgrad des Oxidationsmittels war 70%.
Beispiel 5
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit dem Molarverhältnis Natriumperoxid. Kaliumcarbonat wie 3:1. Bei gleicher Klemmenspannung und Stromdichte war die Stabilbetriebszeit nur 5 min. Der Ausnutzungsgrad des Oxidationsmittels war 50%.
Beispiel 6
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit dem Molarverhältnis Natriumperoxid. Kaliumcarbonat wie 1 : 1,5. Bei einer Klemmenspannung von 1,0 V wurde die Stromdichte von 29 mA/cm entwickelt, die während 11 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war 80%.
Beispiel 7
Die Zelle wurde wie im Beispiel 3 hergestellt, aber mit einer Anode aus Lithium. Bei Aktivierung durch destilliertes Wasser wurde die Stromdichte von 350 mA/cm2 bei einer Klemmenspannung von 2,9 V während weniger als 1 sec entwickelt. Die stabile Stromentwicklung dauerte 10 min. Der Ausnutzungsgrad des Oxidationsmittels war 90%.
Beispiel 8
Die Anode der Zelle wurde aus einer Legierung von Magnesium mit 2% Aluminium hergestellt und die Kathode durch aufeinanderfolgendes Pressen von mit 8% Polytetrafluorethylen gemischter Aktivkohle (Korngröße 0,15- 0,2 mm) und von Peroxidcarbamid mit 4% von Polyethylen auf das Nickelnetz verfertigt. Bei Aktivierung durch Meerwasser entwickelte die Zelle nach weniger als 1 sec die Stromdichte von 22 mA/cm2 bei der Klemmenspannung von 1,0 V, die während 60 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war 90%.
Beispiel 9
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit 10% Polyethylen im Gemisch mit Peroxidcarbamid. Bei derselben Klemmenspannung von 1,0 V entwickelte die Zelle die Stromdichte von 21 mA/cm2, die während 100 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war mehr als 99%.
Beispiel 10
Die Zelle wurde wie im vorigen Beispiel hergestellt, aber mit 20% Polyethylen im Gemisch mit Peroxidcarbamid. Bei derselben Klemmenspannung von 1,0 V entwickelte die Zelle die Stromdichte von 17 mA/cm2, die während 80 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war 80%.
Beispiel 11
Die Zelle wurde wie im Beispiel 9 hergestellt, aber durch destilliertes Wasser aktiviert. Bei derselben Klemmenspannung von 1,0 V entwickelte die Zelle die Stromdichte von 21 mA/cm2, die während 100 min stabil blieb. Der Ausnutzungsgrad des Oxidationsmittels war mehr als 99%.
Beispiel 12
Die Batterie wurde aus 21 Zellen, die gleich der beschriebenen im Beispiel 9 waren, zusammengestellt. Dabei wurden 20 Zellen aus Elektroden, die für eine Betriebsdauer von 60 min geeignet sind, eine aber, die mittlere, aus Elektroden für eine nur dreißigminütige Betriebsdauer hergestellt. Bei Aktivierung durch Meerwasser entwickelte die Batterie den Strom von 180 A, der während 30 min stabil blieb. Danach sank der Strom bis 171 A und blieb stabil während der nächsten 30 min.
Der Vergleich der Beispiele 1 und 2 zeigt den Vorteil der Anoden aus Magnesiumlegierung mit 2% Aluminium gegenüber den Anoden aus reinem Magnesium.
Die Beispiele 3-6 zeigen die Wichtigkeit, das Molarverhältnis des Peroxids zu Alkalisalz zwischen 1,5: 1 und 1 : 1,5 vorzunehmen.
Der Vergleich der Beispiele 9 und 11 zeigt die Unabhängigkeit der Betriebsfähigkeit der Zellen von der Salzhaltigkeit des Wassers für die Aktivierung.
Die Beispiele 8,9 und 10 zeigen den Einfluß der Quantität des verwendeten Bindemittels in der aktiven Schicht der Kathode.
Die Beispiele 2, 3 und 7 zeigen die Möglichkeiten der Entwicklung hoher Leistungen während kürzerer Zeiten, und die Beispiele 8—11 die Möglichkeit der Erhaltung langanhaltender stabiler Leistungen.
Man kann sehen, daß die Möglichkeiten der erfindungsmäßigen Zellen bedeutend höher sind, als bei bekannten wasseraktivierten Zellen.
In einigen Fällen ist es ausreichend, die erfindungsmäßigen Zellen zu benutzen, meistens ist es aber notwendig, Batterien aus solchen Zellen zusammenzusetzen. Die Batterien können z. B. aus bipolaren Elektroden, den bekannten Prinzipien entsprechend, zusammengebaut sein.
Erfindungsgemäße Zellen und Batterien sind in verschiedenen Konstruktionsausgestaltungen, je nach Bedürfnissen und Anforderungen, realisierbar; auch ihre absoluten Ausmaße, damit also die Leistungen können sehr verschieden sein. Z. B., es ist möglich, kreisförmige Elektroden vom Durchmesser 50 cm herzustellen.
Im Allgemeinen sind die erfindungsgemäßen Zellen und Batterien durch folgende Eigenschaften ausgezeichnet:
- Aktivierung durch beliebiges Wasser, ohne besondere Anforderungen bezüglich Salzhaltigkeit oder Reinheit.
- Sehr kurze Aktivierungszeit: in allen Fällen dauert sie nicht länger als 1 sec.
- Unabhängigkeit der Betriebsfähigkeit von der Eintauchtiefe; diese wurde bis Eintauchtiefen von 5 km durch Hochdruckexperimente bestätigt.
- Hohe Sicherheit, besonders dank der Unmöglichkeit der Umpolung.
Stabilität von Strom und Spannung bis zum fast vollständigem Verbrauch der aktiven Materialien.
- Die durchschnittliche Leistung beträgt 0,3 kW pro kg oder 0,15 kW pro dm3.
Die Zellen und Batterien nach der vorliegenden Erfindung besitzen eine Vielzahl von Anwendungsmöglichkeiten. Vor allem sind sie nützlich als Notstromquellen, besonders für Schiffe und andere Schwimmgeräte; weiter können sie als Signalgeber für Wassereintritt dienen; man kann solche Batterien auch in verschiedenen ozeanographischen Geräte verwenden; schließlich können sie in der Touristik, auf Fahrten und Reisen, beim Camping usw. benutzt werden.
Patentansprüche
- Wasseraktivierte Primärzelle, die aus einer Anode (1) aus Lithium, Magnesium oder einer Magnesiumlegierung und einer Kathode, die ein leitendes Metallnetz und einen Depolarisator in sich enthält, besteht, wobei die Kathode von der Anode durch eine Zwischenlage (6) getrennt ist, dadurch gekennzeichnet, daß die Kathode aus zwei mit einem leitenden Metallnetz (4) verbundenen Schichten besteht, wobei die der Anode zugewandte Schicht (3) aus einem leitenden porösen Material zusammengesetzt und auf dem leitenden Metallnetz direkt aufgetragen ist und die andere Schicht (5) mindestens eine aktive Substanz enthält, die als Verbindung oder im Gemisch mit einem Füllstoff vorliegt und die eine depolarisierende, mindestens ein Oxidationsmittel in sich enthaltende leitende Lösung unter der Wirkung des Wassers bildet.
- Zelle nach Anspruch 1, dadurch gekennzeichnet, daß die die mindestens eine aktive Substanz enthaltende Schicht (5) der Kathode aus einem Gemisch von Natriumperoxid mit Kaliumcarbonat im Molarverhältnis von 1 : 1,5 bis 1,5 : 1 und mit 4-15% Polyethylen als Bindemittel zusammengesetzt ist.
- Zelle nach Anspruch 1, dadurch gekennzeichnet, daß die die mindestens eine aktive Substanz enthaltende Schicht der Kathode aus Natriumpercarbonat mit 4-15% Polyethylen als Bindemittel zusammengesetzt ist.
- Zelle nach Anspruch 1, dadurch gekennzeichnet, daß die die mindestens eine aktive Substanz enthaltende Schicht der Kathode aus einem Gemisch von Peroxidcarbamid mit 4-20% Polyethylen zusammengesetzt ist.
- Zelle nach einem der Ansprüche 1 bis 4, dadurch gekennzeichnet, daß die leitende poröse Schicht der Kathode aus einem Gemisch von Aktivkohle von Korngröße 0,1-0,5 mm und 1-15% Polytetrafluorethylen zusammengesetzt ist.
- Zelle nach einem der Ansprüche 1 bis 5, dadurch gekennzeichnet, daß die Anode aus einer Legierung von Magnesium mit 2% Aluminium besteht.
- Zelle nach einem der Ansprüche 1 bis 6, dadurch gekennzeichnet, daß das leitende Metallnetz der Kathode aus Nickel besteht.
- Verwendung einer Zelle nach einem der Ansprüche 1 bis 7 in einer wasseraktivierten Batterie.
-